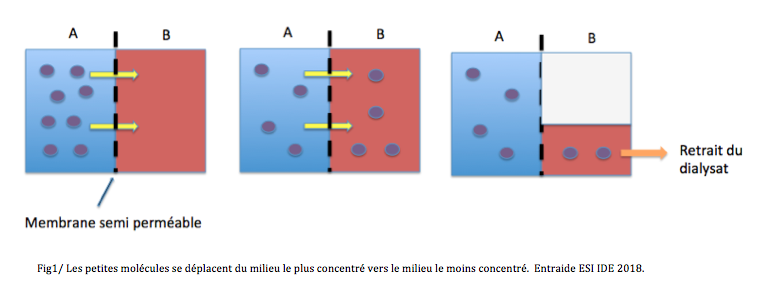
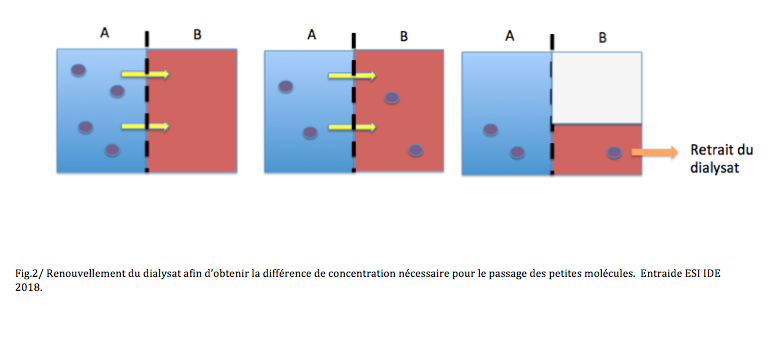
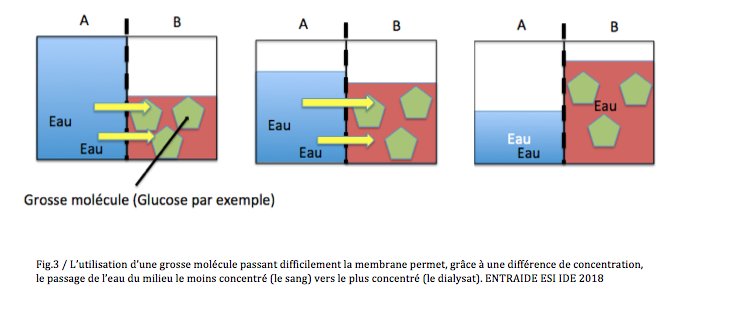
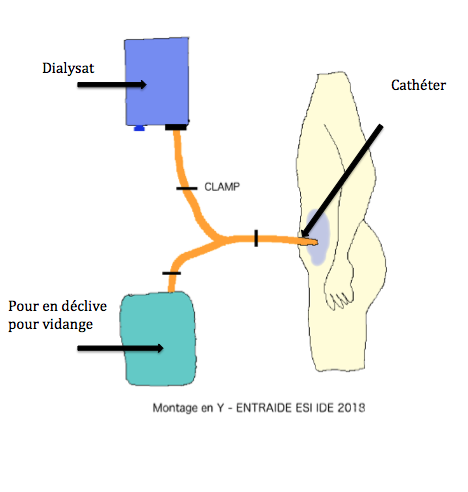
La défaillance organique du rein temporaire ou définitive…

1- Rappels anatomiques
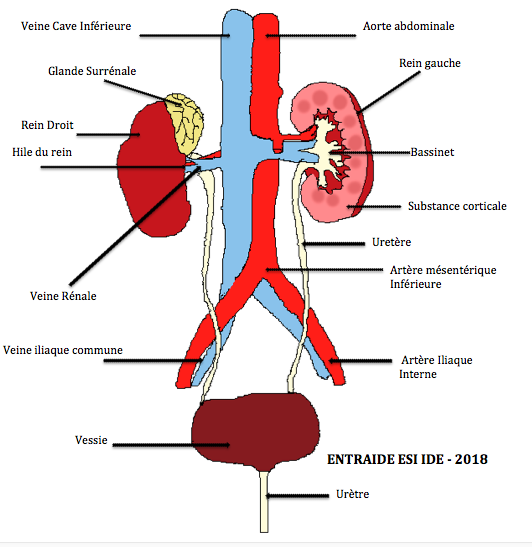
Les reins sont au nombre de deux, et sont situés dans la partie postérieure de l’abdomen, de part et d’autre de la colonne vertébrale, sous les dernières côtes. Chaque rein mesure environ 11 cm, de long et est relié à l’artère aorte et à la veine cave inférieure par l’artère et la veine rénale. Le rein a pour fonction de former l’urine en filtrant le sang. L’urine formée est collectée au milieu du rein et s’écoule ensuite par l’uretère jusqu’à la vessie pour y être stockée avant d’être éliminée par le canal appelé urètre.
Les fonctions des reins sont :
- La filtration/épuration : du sang afin d’éliminer les toxines produites par le fonctionnement normal du corps.
- L’équilibration : du « milieu intérieur » essentiellement de l’eau et des sels minéraux (sodium, potassium, calcium, bicarbonate, magnésium) ; régulation de l’équilibre acido-basique
- La régulation de la pression artérielle : par la production d’hormones et la régulation de la quantité d’eau et de sodium de l’organisme
- La sécrétion de vitamine D : rôle important dans la minéralisation de l’os et le maintien du taux sanguin de calcium (nécessaire pour la fixation de la vitamine D)
- La sécrétion d’EPO (érythropoïétine) : qui stimule la production de l’hémoglobine et des globules rouges par la moelle osseuse
- La fonction endocrinienne
2- Définitions
On distingue deux types d’insuffisances rénales :
- L’insuffisance rénale aiguë (IRA) = dysfonctionnement transitoire et réversible des reins
- L’insuffisance rénale chronique (IRC) = destruction progressive et irréversible des reins
3- L’insuffisance rénale aiguë
3.1- Définition
Baisse importante et subite du débit de filtration glomérulaire qui peut durer de quelques heures à quelques jours. Pour cela il faut effectuer un dosage du taux sanguin de créatinine (protéine éliminée normalement par les reins) qui se trouvera fortement augmentée (norme : homme= 8-13 mg/L, femme = 6-10 mg/L).
3.2- Signes cliniques
- Oligurie/anurie
- Œdème (des membres inférieurs ou OAP)
- Altération de l’Etat Général (AEG)
- Douleurs à la palpation
- Troubles digestifs
- Urémie
3.3- Étiologies
- L’insuffisance rénale aiguë fonctionnelle = pré-rénale
Peut être causée par une hypovolémie (choc hémorragique ou anaphylactique), une déshydratation extracellulaire (digestive, cutanée, rénale par exemple avec l’utilisation de diurétiques) ou l’utilisation de certains médicaments (diurétiques, AINS, anesthésiques…). Pour confirmer la cause fonctionnelle il faut réaliser un ionogramme sanguin et urinaire.
- L’insuffisance rénale aiguë obstructive
Il faut pour cela rechercher la présence d’un obstacle intra-vésicale (caillot, tumeur, lithiases), ou sous vésicale (hypertrophie de la prostate, lithiases, tumeur…). Pour confirmer la cause obstructive il faut réaliser une échographie rénale à la recherche de l’obstacle. Une tomodensitométrie abdomino-pelvienne peut aussi permettre le diagnostic.
- L’insuffisance rénale aiguë organique
Plusieurs étiologies possibles : vasculaires (HTA maligne, emboles, occlusion aiguë de l’artère ou de la veine rénale…), glomérulaires (syndrome néphrotique aigu, glomérulonéphrite rapidement progressive), tubulaires (état de choc, toxique, rhabdomyolyse, obstruction intra-tubulaire…), interstitielles (infection, immuno-allergique, infiltration cellulaire). Pour confirmer la cause organique il faut réaliser un ECBU, analyse du sédiment urinaire, protéinurie des 24H, électrophorèse des protéines urinaires. Il peut aussi être réalisé une ponction biopsie rénale.
3.4- Traitements
- Pour l’IRA obstructive : drainage en urgence des urines par sonde vésicale, cathéter sus-pubien, sonde JJ, néphrostomie et traitement de l’obstacle (lithotritie extra corporelle,…)
- Pour l’IRA fonctionnelle : arrêt des traitements néphrotoxiques, correction du choc hypovolémique ou anaphylactique
- Pour l’IRA organique : traitement de la cause
4- L’insuffisance rénale chronique (IRC) et terminale (IRT)
4.1- Définition
Diminution permanente et irréversible du débit de filtration glomérulaire (DFG), secondaire à une maladie rénale évoluant depuis plus de 3 mois et pouvant aboutir à une insuffisance rénale terminale. L’IRC se définit par un DFG < à 80ml/min et l’IRT par un DFG < à 15 ml/min (norme = 120 ml/min).
4.2- Signes cliniques
- Signes biologiques : Augmentation de la créatinine, baisse de la clairance de la créatinine, protéinurie, hématurie, leucocyturie
- Manifestations hématologiques : Anémie, troubles de l’hémostase, déficit immunitaire
- Manifestations cardio-vasculaires : HTA, surcharge hydro-sodée, hypertrophie ventriculaire gauche, athérosclérose accélérée
- Perturbations métaboliques : Hypocalcémie, hyperphosphorémie, acidose métabolique, dyslipidémie, malnutrition
- Manifestations neurologiques : Troubles mnésiques, troubles du sommeil, polynévrite, impatiences
- Manifestations digestives : Nausée, vomissement, anorexie, œsophagite
- Manifestations cutanées : Prurit, calcifications cutanées, pigmentation cireuse
- Manifestations endocriniennes : Dysménorrhées, hypofertilité, baisse de libido, dysfonction érectile
4.3- Étiologies
- Néphropathies vasculaires et hypertensives
- Néphropathie diabétique
- Glomérulonéphrites chroniques
- Néphropathies héréditaires (polykystoses rénales essentiellement)
- Néphropathies interstitielles chroniques
- Néphropathies d’origine indéterminée
4.4- Traitements
- Règles diététiques : Régime hyposodé, hypoprotidique, pauvre en potassium ; Adaptation de la quantité de boisson à la diurèse.
- Traitement de l’hypertension : Inhibiteurs du système rénine-angiotensine (Razilex®), diurétiques (Lasilix®, Esidrex®).
- Traitement de l’anémie : EPO (Aranesp®, Eprex®, Mircera®,…), fer (Tardyferon®, Fumafer®, Venofer®,…).
- Correction des troubles phosphocalciques : Vitamine D (Uvedose®, Dedrogyl®, Un Alfa®,…), calcium (Calcidia®, Cacit®,…), chélateur du phosphore = substance qui entoure la molécule du phosphore afin de l’éliminer dans les selles (Rénagel®, Renvela®, …).
- Correction des troubles métaboliques : Kayexalate® pour l’hyperkaliémie, bicarbonates pour l’acidose métabolique, statines pour la dyslipidémie (Elisor®, Tahor®,…) et équilibrer le diabète.
4.5- Traitements de l’insuffisance rénale terminale
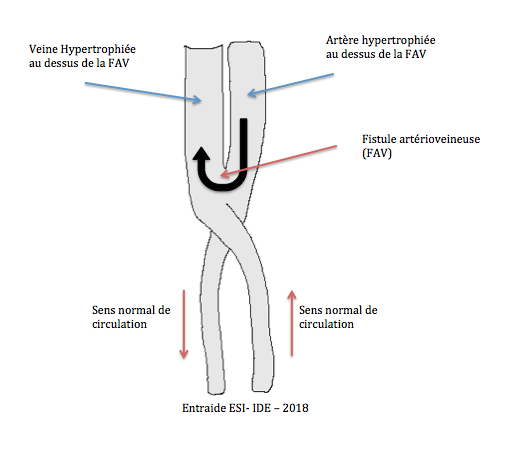
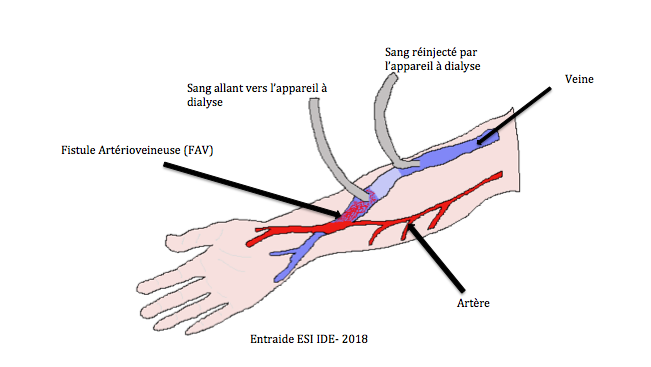
- Hémodialyse : technique permettant d’épurer le sang par le biais d’un rein artificiel
- Dialyse péritonéale : technique utilisant le péritoine comme filtre pour épurer le sang
- Greffe rénale : consiste à implanter un greffon prélevé sur un donneur décédé, ou vivant, ou par le biais de dons croisés

SOURCES
- INSERM, « Insuffisance rénale, décrypter les mécanismes de destruction du rein » [En ligne], https://www.inserm.fr/information-en-sante/dossiers-information/insuffisance-renale (consulté le 27/08/2020)
- Hôpitaux Universitaires Genève, « L’insuffisance rénale chronique, des réponses à vos questions » [En ligne], https://www.hug.ch/sites/interhug/files/documents/insuffisance_renale_chronique.pdf (consulté le 27/08/2020)
- Association française d’urologie, « chapitre 21 – insuffisance rénale aiguë – anurie » [En ligne], https://www.urofrance.org/congres-et-formations/formation-initiale/referentiel-du-college/insuffisance-renale-aigue-anurie.html (consulté le 27/08/2020)
- Cours personnels IFSI
- L’infirmière Magazine, « Dossier », Janvier 2018